Ppt Nomenclatura Inorgánica 5z3r2y
This document was ed by and they confirmed that they have the permission to share it. If you are author or own the copyright of this book, please report to us by using this report form. Report 3i3n4
Overview 26281t
& View Ppt Nomenclatura Inorgánica as PDF for free.
More details 6y5l6z
- Words: 932
- Pages: 19
Nomenclatura Inorgánica
Nomenclatura Inorgánica LOGRO: • Formula y nombra los compuestos químicos • Reconoce las funciones químicas inorgánicas
Fórmula Química • Expresa la composición de moléculas y compuestos mediante símbolos químicos. Ejemplo :H2O, CO2, etc.) • Método sistemático de nombrar los compuestos: nomenclatura.
Formulación General C
X+
-Y
+ A
C Y AX
Donde :
• CyA • XeY
son elementos o iones son estados de oxidación
Se busca que siempre la molécula sea neutra, por lo tanto: ba + (- ba) = 0
Principales Funciones Inorgánicas Hidrogeno
Metal +
Hidruro metálico
+
Oxigeno
Oxigeno
+
No Metal
Hidrogeno +
Oxido Ácido ó anhídrido
Agua
Agua
Óxido Básico
+
+
Ácido Oxácido
Hidróxido Básico +
Sal Oxisal +
Sal Haloidea
Ácido Hidrácido
Número de Oxidación de elementos más frecuentes
Nomenclatura • Conjunto de expresiones y reglas que se utilizan para asignar un nombre a un compuesto químico.
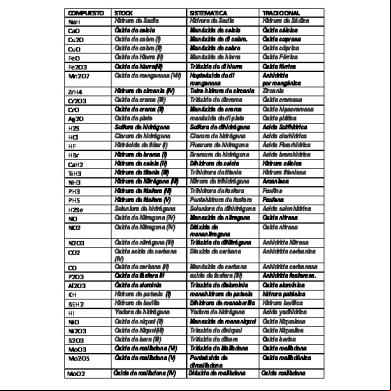
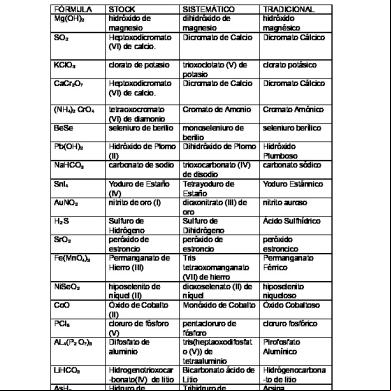
• Actualmente éstas normas son establecidas por la IUPAC (International Union of Pure and Applied Chemistry) • Existen 3 tipos de nomenclatura: Tradicional, de Stock y la Sistemática o IUPAC.
Nomenclatura Tradicional • Se utilizan una serie de prefijos y sufijos para poder distinguir los estados de oxidación del metal o no metal que forma parte del compuesto. Prefijos y sufijos utilizados en la nomenclatura tradicional Cantidad de E.O.
Prefijo ….. Sufijo ….. …..
2
Con la menor Con la mayor
oso ico
3
Con la menor Con la 2da Con la mayor
Hipo ….. oso ….. oso ….. ico
4
Con la menor Con la 2da Con la 3ra Con la mayor
Hipo ..... ….. ….. Per .....
oso oso ico ico
Nomenclatura Sistemática * Se utiliza la palabra óxido acompañado de los prefijos: MONO, DI, TRI, TETRA, PENTA, HEXA, ... CO2 dióxido de carbono Cl2O3 trióxido de dicloro
* Si en el óxido hay un solo átomo del metal ó no metal , se omite el prefijo mono
Nomenclatura Stock Cuando el elemento metálico ó no metálico tiene más de una valencia, ésta se indica al final del nombre con números romanos y entre paréntesis: FeO Oxido de hierro (II) Fe2O3 Oxido de hierro (III) SO3 Oxido de azufre (VI)
Función oxido Los óxidos son combinaciones binarias de oxígeno con cualquier elemento químico. Elemento + Oxígeno Óxido
ÓXIDO BÁSICO: oxígeno con metal. Formulación:
Mx+O2-
M2Ox
E.O. del ión metálico
Compuesto
Nomenclatura Tradicional
Fe2+
FeO
óxido ferroso
Fe3+
Fe2O3
óxido férrico
Li1+
Li2O
óxido de litio
Óxido Acido ó Anhídrido Oxígeno con un no metal. Se usa la nomenclatura tradicional. E.O. del ión no metálico
Formulación:
NMx+O2-
NM2Ox
Compuesto
Nomenclatura Tradicional
S2+
SO
Anhídrido hiposulfuroso
S4+
SO2
Anhídrido sulfuroso
S6+
SO3
Anhídrido sulfúrico
C2+
CO
Anhídrido carbonoso
C4+
CO2
Anhídrido carbónico
Hidróxido • Son compuestos ternarios que se forman al reaccionar un óxido con el agua. Posee el grupo funcional hidróxido (OH-). M2Ox + H2O M(OH)x
Formulación:
Mx+(OH)-1 M(OH)x Na1+ OH- NaOH Ca2+ OH- Ca(OH)2
Compuesto
Nomenclatura Tradicional
NaOH
hidróxido sódico
Ca(OH)2
hidróxido cálcico
Fe(OH)3
hidróxido férrico
Al(OH)3
hidróxido de aluminio
Ácido Oxácido Se forma por la reacción de un oxido ácido o anhídrido con el agua C(2,4)
CO + H2O
H2CO2
CO2 + H2O
H2CO3
Formulación
HNMO a+1
H2NMO a+2
2
E.O IMPAR Donde:
2
E:O PAR
NM = no metal a = estado de oxid.
Nomenclatura La palabra oxido es cambiada por ÁCIDO
H3NMO a+3 2
B, P, As, Sb
Ejemplo No Metal Cl1+ Cl3+ Cl5+ Cl7+ S2+ S4+ S6+ B3+ P5+
Ácido Oxácido HClO HClO2 HClO3 HClO4 H2SO2 H2SO3 H2SO4 H3BO3 H3PO4
Nomenclatura tradicional Acido hipocloroso Acido cloroso Acido clórico Acido perclórico Acido hiposulfuroso
Acido sulfuroso Acido sulfúrico Acido bórico Acido fosfórico
Ácido hidrácido Son compuestos binarios formados por hidrógeno y un no metal . Los no metales que forman estos ácidos son los siguientes: Fluor, cloro, bromo, yodo (con E.O. 1-) Azufre, selenio, teluro (con E.O. 2-) Formulación: H1+ NMxEjemplo:
HxNM
H+ Cl1-
HCl
Ácido clorhídrico
H+ S2-
H2S
Ácido sulfurhídrico
Sales • Son compuestos iónicos, sólidos a temperatura ambiente y por lo general se disuelven en agua. En general, las sales se forman por reacción de un ácido con un hidróxido:
Hidróxido + Ácido Sal + H2O • Estructuralmente, una sal está formada por un catión metálico proveniente del hidróxido y un anión que proviene del ácido. Formulación:
Catióna+ Aniónb- Catiónb Anióna
Sal oxisal Son compuestos ternarios formados por un metal unido a un ( no metal y oxígeno) que constituyen un radical. Se obtienen por neutralización total de un oxácido y un hidróxido. HNO3 + NaOH Ion nitrato
Ion sodio
H2SO4 + Fe(OH)2 Ion sulfato
NaNO3 + H2O Nitrato de sodio
FeSO4 + H2O
Ion ferroso Sulfato ferroso
Compuestos Comunes Sal
Compuesto responsable de su actividad Cloruro de sodio
Cal viva
Óxido de calcio
CaO
Producción de cal apagada
Leche de magnesia
Hidróxido de magnesio
Mg (OH)2
Antiácido y laxante
Hielo seco
Dióxido de carbono
CO2
Extinguidor de fuego
Sosa cáustica
Hidróxido de sodio
NaOH
Fabricación de jabón
Cal apagada
Hidróxido de calcio
Ca(OH)2
Neutralizar terrenos ácidos
Mármol, piedra caliza.
Carbonato de calcio
CaCO3
En la industria del cemento,
Ácido de batería
Ácido sulfúrico
H2SO4
Limpiador de metales.
Cuarzo
Óxido de silicio (IV)
SiO2
Arena para construcción
Ácido muriático
Ácido clorhídrico
HCl
Limpiador de metales
Potasa cáustica
Hidróxido de potasio
KOH
Destaquear tuberías
Anestesia
Dióxido de nitrógeno
N2O
Anestésico
Herrumbre
Óxido de hierro (III)
Fe2O3
Polvo
Carbonato ácido de sodio o
NaHCO3
Antiácido, extinguidor de
Nombre común
Polvo de hornear
bicarbonato de sodio
Fórmula química del compuesto Para qué se utiliza activo NaCl Sazonador
fuego
Nomenclatura Inorgánica LOGRO: • Formula y nombra los compuestos químicos • Reconoce las funciones químicas inorgánicas
Fórmula Química • Expresa la composición de moléculas y compuestos mediante símbolos químicos. Ejemplo :H2O, CO2, etc.) • Método sistemático de nombrar los compuestos: nomenclatura.
Formulación General C
X+
-Y
+ A
C Y AX
Donde :
• CyA • XeY
son elementos o iones son estados de oxidación
Se busca que siempre la molécula sea neutra, por lo tanto: ba + (- ba) = 0
Principales Funciones Inorgánicas Hidrogeno
Metal +
Hidruro metálico
+
Oxigeno
Oxigeno
+
No Metal
Hidrogeno +
Oxido Ácido ó anhídrido
Agua
Agua
Óxido Básico
+
+
Ácido Oxácido
Hidróxido Básico +
Sal Oxisal +
Sal Haloidea
Ácido Hidrácido
Número de Oxidación de elementos más frecuentes
Nomenclatura • Conjunto de expresiones y reglas que se utilizan para asignar un nombre a un compuesto químico.
• Actualmente éstas normas son establecidas por la IUPAC (International Union of Pure and Applied Chemistry) • Existen 3 tipos de nomenclatura: Tradicional, de Stock y la Sistemática o IUPAC.
Nomenclatura Tradicional • Se utilizan una serie de prefijos y sufijos para poder distinguir los estados de oxidación del metal o no metal que forma parte del compuesto. Prefijos y sufijos utilizados en la nomenclatura tradicional Cantidad de E.O.
Prefijo ….. Sufijo ….. …..
2
Con la menor Con la mayor
oso ico
3
Con la menor Con la 2da Con la mayor
Hipo ….. oso ….. oso ….. ico
4
Con la menor Con la 2da Con la 3ra Con la mayor
Hipo ..... ….. ….. Per .....
oso oso ico ico
Nomenclatura Sistemática * Se utiliza la palabra óxido acompañado de los prefijos: MONO, DI, TRI, TETRA, PENTA, HEXA, ... CO2 dióxido de carbono Cl2O3 trióxido de dicloro
* Si en el óxido hay un solo átomo del metal ó no metal , se omite el prefijo mono
Nomenclatura Stock Cuando el elemento metálico ó no metálico tiene más de una valencia, ésta se indica al final del nombre con números romanos y entre paréntesis: FeO Oxido de hierro (II) Fe2O3 Oxido de hierro (III) SO3 Oxido de azufre (VI)
Función oxido Los óxidos son combinaciones binarias de oxígeno con cualquier elemento químico. Elemento + Oxígeno Óxido
ÓXIDO BÁSICO: oxígeno con metal. Formulación:
Mx+O2-
M2Ox
E.O. del ión metálico
Compuesto
Nomenclatura Tradicional
Fe2+
FeO
óxido ferroso
Fe3+
Fe2O3
óxido férrico
Li1+
Li2O
óxido de litio
Óxido Acido ó Anhídrido Oxígeno con un no metal. Se usa la nomenclatura tradicional. E.O. del ión no metálico
Formulación:
NMx+O2-
NM2Ox
Compuesto
Nomenclatura Tradicional
S2+
SO
Anhídrido hiposulfuroso
S4+
SO2
Anhídrido sulfuroso
S6+
SO3
Anhídrido sulfúrico
C2+
CO
Anhídrido carbonoso
C4+
CO2
Anhídrido carbónico
Hidróxido • Son compuestos ternarios que se forman al reaccionar un óxido con el agua. Posee el grupo funcional hidróxido (OH-). M2Ox + H2O M(OH)x
Formulación:
Mx+(OH)-1 M(OH)x Na1+ OH- NaOH Ca2+ OH- Ca(OH)2
Compuesto
Nomenclatura Tradicional
NaOH
hidróxido sódico
Ca(OH)2
hidróxido cálcico
Fe(OH)3
hidróxido férrico
Al(OH)3
hidróxido de aluminio
Ácido Oxácido Se forma por la reacción de un oxido ácido o anhídrido con el agua C(2,4)
CO + H2O
H2CO2
CO2 + H2O
H2CO3
Formulación
HNMO a+1
H2NMO a+2
2
E.O IMPAR Donde:
2
E:O PAR
NM = no metal a = estado de oxid.
Nomenclatura La palabra oxido es cambiada por ÁCIDO
H3NMO a+3 2
B, P, As, Sb
Ejemplo No Metal Cl1+ Cl3+ Cl5+ Cl7+ S2+ S4+ S6+ B3+ P5+
Ácido Oxácido HClO HClO2 HClO3 HClO4 H2SO2 H2SO3 H2SO4 H3BO3 H3PO4
Nomenclatura tradicional Acido hipocloroso Acido cloroso Acido clórico Acido perclórico Acido hiposulfuroso
Acido sulfuroso Acido sulfúrico Acido bórico Acido fosfórico
Ácido hidrácido Son compuestos binarios formados por hidrógeno y un no metal . Los no metales que forman estos ácidos son los siguientes: Fluor, cloro, bromo, yodo (con E.O. 1-) Azufre, selenio, teluro (con E.O. 2-) Formulación: H1+ NMxEjemplo:
HxNM
H+ Cl1-
HCl
Ácido clorhídrico
H+ S2-
H2S
Ácido sulfurhídrico
Sales • Son compuestos iónicos, sólidos a temperatura ambiente y por lo general se disuelven en agua. En general, las sales se forman por reacción de un ácido con un hidróxido:
Hidróxido + Ácido Sal + H2O • Estructuralmente, una sal está formada por un catión metálico proveniente del hidróxido y un anión que proviene del ácido. Formulación:
Catióna+ Aniónb- Catiónb Anióna
Sal oxisal Son compuestos ternarios formados por un metal unido a un ( no metal y oxígeno) que constituyen un radical. Se obtienen por neutralización total de un oxácido y un hidróxido. HNO3 + NaOH Ion nitrato
Ion sodio
H2SO4 + Fe(OH)2 Ion sulfato
NaNO3 + H2O Nitrato de sodio
FeSO4 + H2O
Ion ferroso Sulfato ferroso
Compuestos Comunes Sal
Compuesto responsable de su actividad Cloruro de sodio
Cal viva
Óxido de calcio
CaO
Producción de cal apagada
Leche de magnesia
Hidróxido de magnesio
Mg (OH)2
Antiácido y laxante
Hielo seco
Dióxido de carbono
CO2
Extinguidor de fuego
Sosa cáustica
Hidróxido de sodio
NaOH
Fabricación de jabón
Cal apagada
Hidróxido de calcio
Ca(OH)2
Neutralizar terrenos ácidos
Mármol, piedra caliza.
Carbonato de calcio
CaCO3
En la industria del cemento,
Ácido de batería
Ácido sulfúrico
H2SO4
Limpiador de metales.
Cuarzo
Óxido de silicio (IV)
SiO2
Arena para construcción
Ácido muriático
Ácido clorhídrico
HCl
Limpiador de metales
Potasa cáustica
Hidróxido de potasio
KOH
Destaquear tuberías
Anestesia
Dióxido de nitrógeno
N2O
Anestésico
Herrumbre
Óxido de hierro (III)
Fe2O3
Polvo
Carbonato ácido de sodio o
NaHCO3
Antiácido, extinguidor de
Nombre común
Polvo de hornear
bicarbonato de sodio
Fórmula química del compuesto Para qué se utiliza activo NaCl Sazonador
fuego